卫材将在第15届CTAD会上展示仑卡奈单抗III期临床试验结果
卫材株式会社将在第15届阿尔茨海默病临床试验(CTAD)会议上介绍仑卡奈单抗(lecanemab,开发代码:BAN2401)Clarity AD III期验证性临床试验的疗效、安全性和生物标志物结果,试验药物仑卡奈单抗是治疗脑内确认存在淀粉样蛋白病理的阿尔茨海默病(AD)所致轻度认知障碍(MCI)和轻度AD(统称为早期AD)的抗淀粉样蛋白 (Aβ) 原纤维抗体。会议将于11月29日至12月2日在加州旧金山举行,卫材和相关研究人员将在会议第一天的科学会议上展示全部数据(11月29日下午4:50 PT)。此外,来自仑卡奈单抗临床开发项目和卫材AD管线的其它重要研究,包括该公司正在研究的抗微管结合区(MTBR)tau抗体(E2814),将通过四个演讲展示和十个海报展示进行介绍。
Clarity AD的顶线(TOPLINE)结果已于9月下旬公布,显示仑卡奈单抗符合主要终点和所有关键次要终点,结果具有高度统计学意义,淀粉样蛋白相关成像异常(ARIA)发生率在预期范围内。
卫材在CTAD上仑卡奈单抗主要报告:
- Clarity AD:在11月29日下午4:50 PT的科学会议上,将公布仑卡奈单抗用于早期AD患者的III期验证性AD临床试验全部结果。卫材将对会议演讲进行网络直播,并可在卫材株式会社网站的投资者栏目中观看直播。
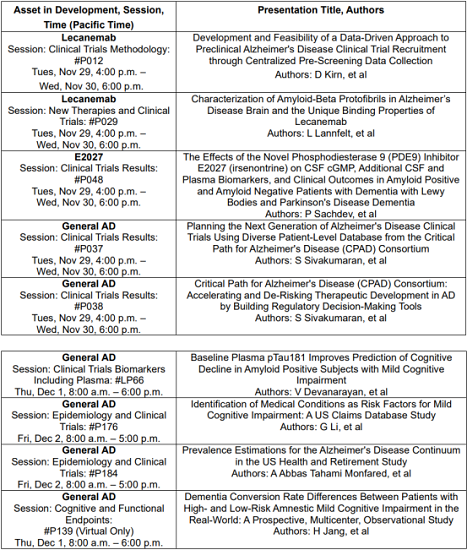
- Aβ原纤维的结合特性:研究Aβ原纤维的特性以及仑卡奈单抗的独特结合特性和Aβ清除机制(海报#P029)。
- AHEAD 3-45研究。
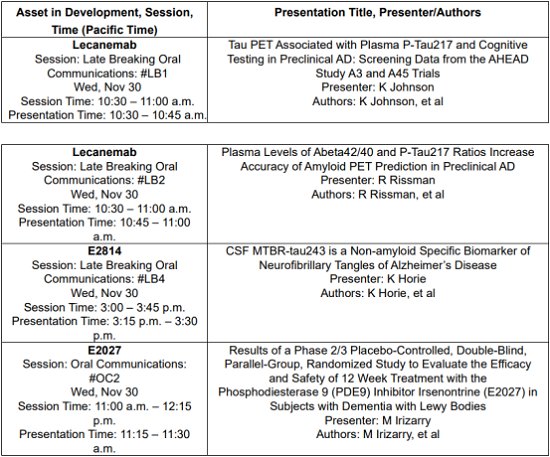
o 评估来自AHEAD 3-45期研究的仑卡奈单抗的tau PET筛选数据与血浆p-tau217和认知测试的关联(Late Breaker Oral #LB1)。
o 利用AHEAD 3-45研究的3期筛查数据中的Abeta42/40和p-tau217比值的血浆水平,探索提高临床前AD中淀粉样蛋白PET预测的准确性(Late Breaker Oral #LB2)。
卫材株式会社阿尔茨海默病和脑健康首席临床官、医学博士Lynn Kramer 表示,“根据Clarity AD的结果,正在研究的抗淀粉样蛋白β原纤维抗体仑卡奈单抗有可能通过减缓认知和功能衰退,对阿尔茨海默病早期患者及其家人产生临床意义的影响。卫材很高兴在CTAD上分享公司的验证性III期Clarity AD临床研究的结果,并展示探索仑卡奈单抗有效性、安全性和在各种早期AD患者亚群中的潜在使用的重要数据。”
CTAD 2022 Presentations Relating to Eisai's Key Compounds, Research and Collaborations

Oral Presentations
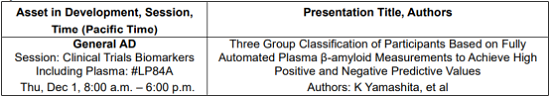
Poster Presentations
Sysmex Poster Presentation
卫材预计在2022财年结束前(截至2023年3月31日)完成美国传统审批程序和在日本和欧洲的上市许可申请。2022年7月,美国食品药品监督管理局(FDA)受理了卫材仑卡奈单抗在快速通道认定下的生物制品许可申请(BLA),并授予优先审查权。处方药用户费用法案的行动(PDUFA)日期定于2023年1月6日。FDA已同意Clarity AD的结果作为验证性研究来支持仑卡奈单抗的临床获益。为了尽快确保FDA对仑卡奈单抗的批准,卫材通过FDA的加速批准途径提交了BLA,以便该机构可以提前完成对验证性Clarity AD研究外的仑卡奈单抗全部数据的审查。2022年3月,卫材开始在事前评估咨询系统下向日本药品和医疗器械局(PMDA)提交除Clarity AD数据外的申请,目的是能够尽早获得仑卡奈单抗的批准,以便早期AD患者能尽快接受治疗。
仑卡奈单抗的全球开发和监管提交由卫材主导,而产品则由卫材和渤健共同商业化和推广,其中卫材拥有最终决策权。
本发布内容讨论了药物在开发中的研究用途,并非旨在传达有关疗效或安全性的结论。无法保证此类研究药物将成功完成临床开发或获得卫生监管当局的批准。
















